等离子体技术及相关物理知识解析
作者:汤卫国 指导老师:蒙林
等离子体手术系统的工作原理[1-2]
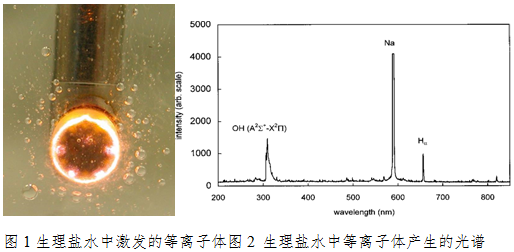
施加一定功率及频率的交流激励在相应的手术刀头上,该激励会在刀头的电极间产生局部高度的焦耳热,局部高度的焦耳热和氧化还原反应会在电极表面形成很薄的气体膜。通过电极的排布设计和材料设计等特殊设计,及施加波形的配合实现电场场强集中,击穿气体膜,形成等离子体。在该等离子体与生理盐水溶液的交界面会形成厚度约为100微米的等离子体鞘层。该等离子体鞘层可以实现离子加速,轰击交界面的溶液表面,激发H+,OH-,Na+等活性基。电场对活性基的加速作用轰击生物组织表面,打断分子链,使得手术创面的组织细胞以分子为单位分解,形成的生物组织颗粒可以通过生理盐水循环排出,从而实现对手术创面的血肉消融,打孔和切割作用。手术中产生的等离子体同时可以对手术创面有消毒杀菌的作用。该手术过程中产生的等离子体的温度很低,可以将温度精确控制在40~70摄氏度范围内,既确保使胶原蛋白分子螺旋结构皱缩,又保持了细胞的活力,在切除病变的同时兼有消融、止血和吸引功能。其作用方式能量级别低,对人体组织损伤范围小;通过操作电极来切割、消融病变组织,快速切割,创口小,相比传统手术而言,缩短手术时间及术后恢复时间。
高频手术系统的工作原理[3]
当高频电流通过人体组织时,由于每一振荡电流的脉冲时间极短,离子很难引起迁移,只在富有结滞性的体液中振荡,从而因振荡摩擦产生大量的热能,高频电刀的热效应是将高频电流振荡产生的热能聚集起来,直接摧毁处于有效电极尖端接触点下的病变组织。当电流在接触人体组织瞬间产生大量热量,使细胞破裂、汽化从而组织分离,即电切效果;而热能使组织或细胞温度上升、细胞失水干燥、蛋白变性,便产生了电凝效果。
从上述两种电外科手术系统我们来用一张图来简单解析其背后的能量形式变换的过程:
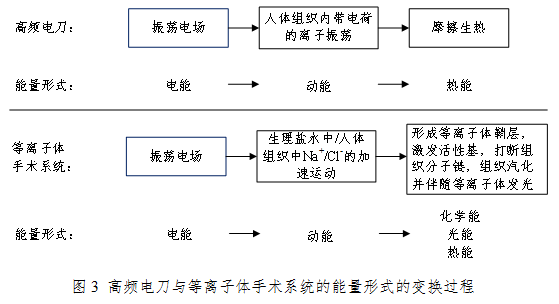
从上图我们可以了解到,等离子体手术系统工作能量形式的变换过程与高频电刀等完全不同。因此,高频电刀的标准和规范不适用于等离子体手术系统。
激励电源工作频率与波形的选择对等离子体形成的影响
低温等离子体在生理盐水中放电的研究[4-5]说明,在等离子体放电过程中,根据阻抗特性可以将其大致分为三个阶段。
第1阶段:预电离阶段,此时溶液中主要进行简单欧姆导电;
第2阶段:蒸汽层形成阶段,即当电压达到等离子体形成的临界电压时,蒸汽层的形成使得溶液阻抗值迅速增大;
第3阶段:等离子体形成阶段,同时伴随有光学和声脉冲以及气泡过程。
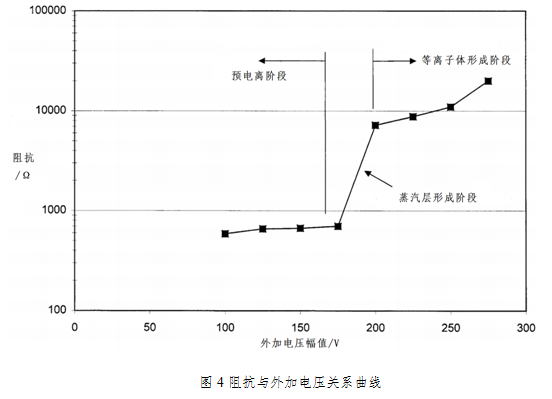
上图的曲线告诉我们,形成等离子体是需要条件的:一定的阈值电压;生理盐水的环境。
根据等离子体手术系统的工作原理,激励电源的波形主要有方波和正弦波的形式。通过下图我们来了解不同激励电源的工作频率与波形对等离子体形成的影响。我们选取工作频率为100kHz的方波和400kHz的正弦波来示例,选取等离子体形成的阈值电压V1作为方波的工作电压,而如果正弦波的最大值仅是达到形成等离子体的阈值电压,则无法正常激励起等离子体,因此正弦波能激励等离子体的电压V2必须高于阈值电压V1。等离子体的手术系统的电极分为工作极和回路极,工作极是该手术系统的有效作用电极,从等离子体手术系统工作的原理我们不难分析出:等离子体形成过程中释放光子,从上面的光谱图示中,我们观察到是589.3nm处的Na+离子的激射跃迁,因Na+离子带正电荷,即当工作极为负电压时,才在电场的作用下作高速的运动向工作极的表面聚集,最终在工作极周围形成了橙色等离子体光晕。因此,这里只分析工作极负电压的半个周期的行为。高中物理知识告诉我们,在恒定的电场作用条件下,带电粒子作匀加速运动;因此波形的选择将给出一个事实:在有效的等离子体形成阶段,方波给带电离子一个匀加速的工作电场,而正弦波则迫使带电离子作变加速运动;方波下降沿陡峭,能快速到达等离子体所需的激励电压,而相比正弦波上升沿缓慢,且需要比方波更高的激励电压才能有效激励起等离子体;未达到等离子体所需的激励电压,正弦波将产生更多的热效应,而选用方波则没有这种困扰(等离子体工作条件);对不同的激励频率而言,我们将有效工作的电压周期向时间轴投影发现,400kHz的正弦波的有效工作时间将低于100kHz的方波的有效工作时间,且正弦波随着频率的增加,该有效工作时间将是减少的。100kHz等离子体在能量转化方面优于400kHz,前者将更多的能量转化为粒子动能及化学活性(因施加的电场频率较低使带电粒子将会有更长的时间加速获取更大动能打断组织分子键),后者则在电场的快速交变过程中产生比较多的热量。而通过增加电压的方式来换取有效工作时间的增加,则会导致正弦波输出功率的增加,增大组织热损伤的风险。
那既然低频会增加粒子动能,是否频率可以再低于100kHz呢?答案是不能(仅限等离子手术设备,其余工业设备可以再低),原因是法拉第效应:因低频交流电与人体神经传导的频率相似而引起的刺激和神经系统传导中断的效应。但生物学家们的实验研究表明,当频率≥100kHz时,法拉第效应显著减小,电流对神经肌肉的刺激可几乎忽略不计,不会发生细胞粒子极化效应。因此,100kHz方波已成为低温等离子手术系统设计频率和波形选择的最优化极限。
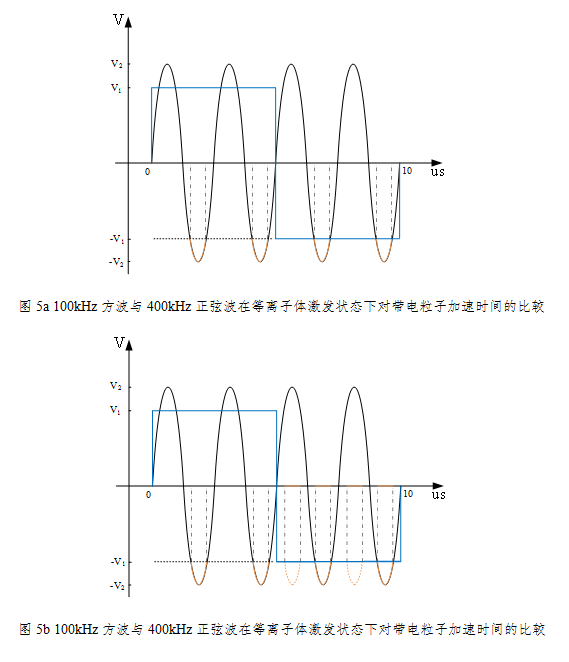
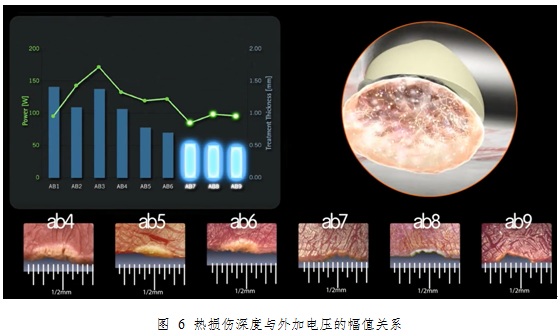
另外,从上图可以看出,随着输出电压的增加,尤其是越过等离子体激发的门限电压后,其治疗组织的深度与几乎保持在0.5mm的深度,并且其热损伤也相比较小的功率档位来的轻。
IEEE(电气电子工程师学会)IEEE Standard 521-2002:standard letter Designations for Radar-Frequency Bands和ITU(国际电信联盟)ITU-R Recommendation V.431: Nomenclature of the frequency and wavelength bands used in telecommunications. International Telecommunication Union均定义频率为30kHz~300kHz的频段为低频,300kHz~3MHz之间的频段为中频。
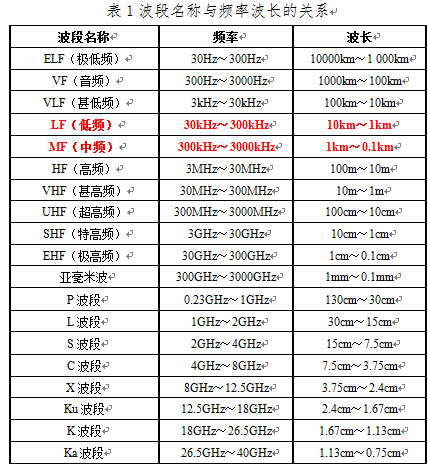
对此处等离子体手术系统而言,因其工作的频段都基本集中在中低频段(同一量级),其工作在300kHz~500kHz技术性的难度是一致的(同样适用于工作于100kHz的低频等离子手术设备),技术上没有差别。熟悉电子电路设计的工程师均了解,其先进性/难度体现在如何解决高频手术设备功率输出的开关电源设计技巧、功率放大设计、电磁兼容、热管理等方面,而非一味拘泥于激励电源开关的工作频率上。
什么才是趋肤效应?
有些产品宣传称:频率低趋肤深度深,组织损伤大,术后并发症偏多;而频率高趋肤深度会小,有利于减少对正常组织的损伤。与低频相比高频电流通过导体的时候,电流只在表皮流动,频率越高,这个趋势越明显。同样道理,高频电流流过人体,电流也是在表皮流动的,而且频率越高,电流流经表皮的深度越浅。
上述表述听起来好像是对趋肤效应的物理解释,但是这种解释只停留在事物的性质的表面,缺乏数据的直接理论支撑。接下来,我来给大家科普一下。
趋肤效应(Skin effect):交变电流通过导线时,电流在导线横截面上的分布是不均匀的,导体表面的电流密度大于中心的密度,且交变电流的频率越高,这种趋势越明显。
我们从研究高频电极和活组织的常用材料的属性入手,并在下表2讨论这些材料在500 kHz/100kHz工作频率下趋肤深度 的表现,其中电导率 ,磁导率 ;。虽然不同人体组织的电导率和相对介电常数并不相同,但为了方便讨论,我们近似认为人体组织的材料属性和弱电离盐溶液的材料属性相近[6]。人体组织的实际材料属性与估计值相差不到一个数量级,但电极和绝缘材料的电导率可能与估计值相差五个数量级以上。
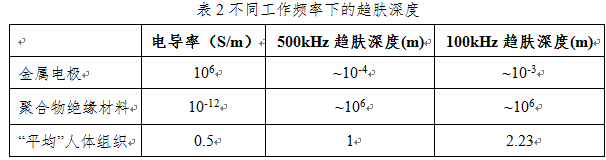
从计算的结果可以看出,人体组织的500kHz/100kHz电流趋肤深度量级均在以米级为单位,但人体组织的厚度显然应该以厘米来计量,显然还差两个量级。
等离子技术与单极技术的不同之处在于,组织效应发生在同一装置的两个电极之间,即工作极与回路极。该系统使用生理盐水电解液,具有比周围组织更低的电阻抗。因此,电流从电极流过生理盐水,再流至回路极,总是走电阻最小的路径;大的回流表面积保证了非常低的电流密度,这增加了等离子体手术系统的安全水平。这与单极电切有根本的不同,在后者中,使用不导电的灌洗液,迫使电流通过病人体内的组织,然后回到中性电极。
人体是由许多有机和无机物质构成的复杂结构,体液中含有大量的电介质,如离子、水、胶原微粒等,人体主要依靠离子移动传导电流;高频电流是按阻抗最小的回路(不一定是最短路径)流动,而且不一定是人为预期的回路流动(人体组织的非连续性),并且趋肤并非特指人体的表皮/皮肤,这里可能存在翻译的因素。因此,生搬硬套的解释这个趋肤效应物理概念是个低级错误。
综上,通过上述对等离子体工作原理阐释,激励电源的工作频率和波形的分析,100kHz方波无论从频率、波形、技术等方面看,在等离子体手术系统的应用中更具技术优势。
参考文献:
[1]Jean Woloszko, Kenneth R. Stalder, Ian G. Brown, Plasma Characteristics of Repetitively-Pulsed Electrical Discharges in Saline Solutions Used for Surgical Procedures [J].Transactions on Plasma Science, 2002,30(3):1376-1383.
[2]Kenneth R. Stalder, Donald F. McMillen, Jean Woloszko, Electrosurgical Plasmas [J].Journal of Physics D: Applied Physics. 2005,38:1728-1738.
[3]耿小平,郭莉,高威,电外科技术的发展与应用 [M].人民军医出版社.2015.
[4] L Schaper, Kenneth R. Stalder, W.G.Graham, Plasma production in electrically conducting liquids [J].Plasma Sources Science and Technology, 2011,20:034004.
[5]张大伟,苗彩娟,马超,低温等离子体在生理盐水中放电的实验研究[J].沈阳理工大学学报,2013,32(2):28-32.
[6] Walter Frei 生物组织射频消融技术的仿真研究[J]. COMSOL Blog, 2016.1
作者及指导老师简介:
汤卫国,1978年11月生,江苏苏州人,工程师,电子科技大学工学硕士。现为四川省等离子体医学工程研究中心战略创新委员会成员。主要研究领域为等离子技术、高压脉冲功率技术。
蒙林,电子科技大学教授
1964年11月生,广西百色人,教授,博士生导师。现任电子科学与工程学院常务副院长。国家科技创新特区主题专家组成员、中国电子学会高级会员、四川省电子学会真空技术分会主任委员、中国核学会脉冲功率技术及其应用分会常务理事、四川省科技青年联合会会员、四川省电子学会高能电子学专业委员会委员、贵州大学兼职教授、电子科技大学科技委委员。
主要从事高功率微波和等离子体物理的教学和科研工作,已获得部级科技进步奖三项、省部级学术(技术)鉴定五项、四川省跨世纪学科带头人后备人选、四川省有特殊贡献的博士学位获得者。在国内外重要学术刊物及国内外学术会议上上发表了学术论文一百余篇。近五年主持国家科技创新特区重大项目一项、国家重大专项项目一项、国家自然科学基金两项及其它项目八项。
电子科技大学211工程建设项目“微波等离子体及其应用基础研究”的负责人和硕士点“等离子体物理” 的学术带头人。





